Лауреаты Нобелевской премии по химии 2018 года. Слева направо: Фрэнсис Арнольд (Frances H. Arnold), Джордж Смит (George P. Smith) и Грег Уинтер (Sir Gregory P. Winter). Фото с сайта sciencenews.org Еще не боги, но уже кое-что...Нобелевская премия по химии — 20186.10.2018Нобелевскую премию по химии в 2018 году разделили между собой трое ученых: половина премии досталась американской исследовательнице Фрэнсис Арнольд «за направленную эволюцию ферментов», вторую половину поровну поделили американец Джордж Смит и Грег Уинтер из Великобритании — «за фаговый дисплей пептидов и антител». Исследования, которые удостоились премии, имеют ярко выраженный прикладной характер, а объединяет их то, что все авторы связаны с разработкой методов для получения полезных для человека белков и пептидов, основанных на имитации естественного «метода» биологической эволюции, а именно — на сочетании случайной изменчивости и неслучайного отбора. Все лауреаты имеют за плечами долгий путь исследовательской работы и множество престижных наград и премий.Белки (также называемые полипептидами) — это наиважнейший класс биополимеров. Каждый полипептид представляет собой цепочку из соединенных одна за другой аминокислот, количество которых может быть очень разным, от нескольких штук до нескольких сотен, а иногда их может быть даже больше тысячи. Короткие цепочки (менее сотни аминокислот) обычно называют не белками, а пептидами: разница здесь скорее количественная, чем качественная. В природе белки строятся в основном из двадцати разновидностей аминокислот. Полипептидные цепочки далее сворачиваются определенным образом, приобретая разнообразные пространственные конфигурации, превращаясь во что-то вроде деталек конструктора LEGO (рис. 1).
Рис. 1. Примеры белковых молекул; показаны модели их трехмерной конфигурации. Рисунок из статьи L. L. Porter, G. D. Rose, 2012. A thermodynamic definition of protein domainsВажность белков для живой природы невозможно переоценить. Во-первых, белки — это строительные блоки, из которых выстроены и сами живые клетки, и остов межклеточного вещества, к которому клетки прикрепляются. Можно наглядно убедиться, что если взять, к примеру, сердце и удалить из него все клетки (эта процедура называется децеллюляризацией), то белковый остов, который при этом останется, полностью сохранит форму полноценного органа (см. картинку дня «Децеллюляризованное сердце»).
Во-вторых, значительная часть белков — ферменты, то есть они являются биологическими катализаторами, которые имеют ряд важных отличительных свойств и преимуществ по сравнению с обычными химическими катализаторами небелковой природы. А именно — необычайно высокую эффективность, специфичность к конкретному типу субстрата и регулируемость: фермент под воздействием определенных внешних факторов или посредством взаимодействия с ним другого белка может переходить из активной формы в неактивную, и наоборот.
В-третьих, некоторые белки — антитела — служат в качестве нанооружия против вражеских агентов (бактерий, вирусов или токсинов), попадающих в организм из внешней среды, выполняя, таким образом, защитную функцию. Это обеспечивается благодаря способности антител прочно связываться с самыми разными молекулами-антигенами.
А еще есть белки-рецепторы, позволяющие живым клеткам воспринимать сигналы (химические или физические) из внешней среды, а также белки-регуляторы, которые управляют реакциями клеток на полученные сигналы, в частности, осуществляя активацию или инактивацию определенных ферментов (белкам-рецепторам и регуляторам посвящена другая нобелевская премия этого года — по физиологии и медицине, см. новость Нобелевская премия по физиологии и медицине — 2018, «Элементы», 04.10.2018).
Нет ничего удивительного в том, что люди видят перспективы в приручении этих замечательных молекул для решения широкого круга задач, выходящих за рамки сугубо естественных процессов. Мы хотели бы создавать новые виды катализаторов, не изобретенных самой природой, а также белки и пептиды, которые бы эффективно связывали любой вид молекул, который нас интересует.
Чтобы получать новые белки с заданными свойствами, их, по идее, нужно сначала изобрести. Свойства белков зависят от пространственной конформации белковой молекулы, а также от распределения в молекуле электрических зарядов. Эти характеристики, в свою очередь, определяются свойствами аминокислот, из которых построен белок. Причем важно не только, какие аминокислоты и в каком количестве входят в цепочку, но и в каком порядке они расположены. Теоретически, зная свойства аминокислот и строение полипептидной цепочки, можно было бы предсказывать конфигурацию и химические свойства конечного белка. А раз так, то почему бы не изобретать белки под свои цели точно так же, как инженеры изобретают всевозможные технические устройства — от шариковых ручек до компьютеров? Увы, не все так просто. Дело в том, что зачастую для одной и той же цепочки аминокислот существует несколько возможных устойчивых конфигураций, а кроме того, в момент взаимодействия с другими молекулами в реакционной смеси конфигурация может меняться из-за перераспределения зарядов в молекуле. Все это крайне затрудняет возможности «рационального дизайна» новых необходимых белков и пептидов.
Выход из этого затруднения есть, и он изобретен миллиарды лет назад самой природой — это метод проб и ошибок: генерирование случайного разнообразия с последующим отбором продуктов, обладающих нужными свойствами. Это и есть, по сути, «метод» природной эволюции белков, и именно за приручение принципа дарвиновской эволюции в целях лабораторной белковой инженерии и была вручена в этом году нобелевская премия по химии.
Премия разделена на две части неспроста — подходы, которые использовала Фрэнсис Арнольд (Frances H. Arnold) для «направленной эволюции ферментов» существенно отличаются от подхода «фагового дисплея», разработанного Джорджем Смитом (George P. Smith) и адаптированного Грегом Уинтером (Sir Gregory P. Winter) для получения специфичных пептидов и антител. Поэтому мы тоже рассмотрим эти две части по отдельности.
Плакат рядом с лабораторией Фрэнсис Арнольд в Калифорнийском технологическом институте. Фото © Н.В.
Фрэнсис Арнольд получила свой первый «неестественный» (non-natural) фермент в 1993 году (K. Chen, F. H. Arnold, 1993. Tuning the activity of an enzyme for unusual environments: sequential random mutagenesis of subtilisin E for catalysis in dimethylformamide). Тогда был получен новый вариант фермента субтилизина Е, который катализирует расщепление и образование пептидных связей (соединений между аминокислотами в пептидных цепочках), причем, благодаря методу направленной эволюции и внесению в исходно взятый природный белок 10 аминокислотных замен, удалось заставить фермент работать в органическом растворителе (60% диметилформамиде) и повысить термостабильность на 18 градусов. По техническим причинам достаточно часто возникает необходимость проводить некоторые реакции химического синтеза в органических растворителях при повышенных температурах, так что этот результат имеет большое значение для практической химии.
Работа прошла через следующие этапы: сначала был найден подходящий природный ген. Выбор гена, с которого следует начать, — вопрос не всегда простой. По словам самой Фрэнсис Арнольд, иногда это вопрос интуиции. Но общий принцип состоит в том, чтобы, по возможности, постараться найти белок, который проявляет способность катализировать нужную реакцию хотя бы в очень слабой степени. Выбранный ген встроили в плазмиду (кольцевую молекулу ДНК), чтобы его можно было размножать в бактериях — кишечных палочках — это достаточно стандартная процедура в генной инженерии (см. подробный рассказ об этом). Далее, при помощи полимеразной цепной реакции (ПЦР) в этот ген ввели четыре заранее спроектированных замены. На этом этапе ученые руководствовались расчетами, основанными на компьютерном моделировании. Эти замены должны были изменить в желаемом направлении форму активного центра фермента и обеспечить более эффективную его работу в требуемых условиях. Нужные замены ввели при помощи праймеров, содержащих замещенные нуклеотиды. Дальше дело за бактериями — в процессе роста и деления они размножают плазмиду и одновременно синтезируют белок, закодированный в этой плазмиде. После этого белок выделяют и тестируют на уровень ферментативной активности.
Активность оставалась все еще слишком низкой. Чтобы улучшить результат, на следующем этапе ген провели через три раунда «мутагенной ПЦР». В такой ПЦР мутации вводятся случайным образом благодаря специально подобранным условиям — таким, в которых фермент ДНК-полимераза совершает «ошибки» чаще обычного. После каждого раунда вводили гены в бактерий, выделяли фермент и проводили скрининг (массовую проверку) с целью поиска самого эффективно работающего варианта. В итоге в белке появилось еще шесть дополнительных замен, и, вуаля! — получен необходимый высоко эффективный фермент.
В дальнейшем Фрэнсис Арнольд, а также другие исследователи, взявшие на вооружение предложенный ею метод, получили еще множество полезных ферментов с необычными свойствами. Методика совершенствовалась: к методам генерирования случайных мутаций добавились методы, предусматривающие также случайный обмен участками между мутантными последовательностями. Либо, в качестве альтернативы, используется обмен участками между природными генами, составляющими большое генное семейство — за время эволюционной истории они уже естественным образом накопили множество мутаций, а комбинаторный подход может помочь на этой базе получить ферменты с новыми свойствами.
Так, очень плодотворными оказались работы по получению катализаторов для необычных химических реакций с семейством генов цитохрома P450. На рис. 2 приведен частичный список естественных и «неестественных» реакций, которые катализируются этой группой ферментов.
Рис. 2. Реакции, которые катализируются природными цитохромами P450 (в левой половине рисунка, на голубом фоне) и новыми ферментами, полученными на их основе методом направленной эволюции: 1 — циклопропанирование, 2 — азидирование, 3 — сульфимидирование, 4 — аминирование C–H связи, 5 — инсерция N–H связи. В центре изображена обобщенная модель трехмерной конфигурации цитохрома P450. Обозначения: R — любой радикал, Ar — ароматический радикал, Ts — тозил. Реакций, показанных на розовом фоне, в природе не существует (или, по крайней мере, пока не обнаружено). Рисунок из статьи F. Arnold, 2015. The nature of chemical innovation: new enzymes by evolutionОбщая схема направленной эволюции ферментов, в ее современном виде, показана на рис. 3.
Рис. 3. Схема процессов, используемых в белковой инженерии. Метод «случайного поиска», лежащий в основе направленной эволюции белков (слева), может в той или иной степени совмещаться с рациональным дизайном, опирающимся на знания о закономерностях взаимосвязи между строением и функциями белков, используемых в программах для виртуального моделирования. Рисунок из статьи V. Stepankova et al., 2013. Strategies for Stabilization of Enzymes in Organic SolventsТаким образом, практический выход работы Фрэнсис Арнольд состоит в том, что посредством предложенного ею метода удается получать катализаторы для реакций, использующихся в фармацевтике и для синтеза искусственных материалов, которые либо не встречаются в природе (например, образование связи между атомом углерода и атомом кремния), либо должны осуществляться в аномальных условиях (в присутствии органических растворителей или химикатов, при высоких или низких температурах и т. д.). Но, кроме того, есть и фундаментальное значение: чем больше получают в лабораториях разных белков, химические и физические свойства которых впоследствии изучаются и сопоставляются, улучшая понимание физики биополимеров, тем выше становится предсказательная сила виртуальных моделей, предназначенных для целенаправленного дизайна нужных белков или для предсказания свойств пока неизученных природных белков.
Теперь поговорим о методе фагового дисплея. В первоначальной версии метод был разработан Джорджем Смитом в 1985 году. Метод основан на использовании бактериофага M13, который размножается в бактериях — кишечных палочках (E. coli). Фаг M13 хорош тем, что его капсид достаточно велик, чтобы вместить геном фага вместе со вставками, даже большими. Суть метода фагового дисплея состоит в том, что в геном бактериофага встраивается фрагмент, кодирующий какой-то интересующий нас пептид, либо целый белок, либо серия разнообразных фрагментов. В самом простом варианте это может быть набор совершенно случайных последовательностей. Встраивание производится в рамку считывания одного из генов, которые кодируют белки капсида (всего у M13 таких белков пять). В результате такого встраивания фрагмента на поверхности фаговых частиц оказываются выставлены (в связке с собственными белками фага) закодированные в данном фрагменте пептиды. Фаги размножаются в бактериях — и по мере размножения естественным образом с некоторой частотой приобретают мутации. В итоге, после извлечения фаговых частиц из зараженных бактерий (миллиарды частиц за один раунд), получаем набор разнообразных версий исходно встроенного фрагмента и кодируемого этим фрагментом пептида. Все эти версии будут представлены на поверхности фагов — это и есть «фаговый дисплей». Так мы получаем первичную библиотеку фаговых частиц.
Фаговые частицы далее можно отобрать по способности связываться с нужными молекулами, а затем те частицы, которые прошли отбор, потому что связываются лучше других, можно снова использовать для заражения бактерий. Отбор проводится при помощи целлюлозных фильтров или магнитных бус, на которых закреплены нужные молекулы (получить представление о том, как происходит сбор нужных молекул на магнитные бусы можно, посмотрев небольшое видео). «Правильные» фаги останутся на носителе, а «неправильные» будут безжалостно смыты. Практика применения фагового дисплея показывает, что достаточно лишь пяти раундов, чтобы получить пептиды с очень высокой эффективностью связывания. Затем образцы ДНК, выделенной из фага, секвенируют, а на основе полученной селектированной последовательности исследователь может составлять генетические конструкции, которые дадут возможность получать необходимые белки в требуемых количествах в любом подходящем объекте — к примеру, в тех же кишечных палочках или дрожжах. Этот метод Грег Уинтер, другой лауреат премии, адаптировал для получения антител к определенным антигенам. Схема, которую он использовал, показана на рис. 4.
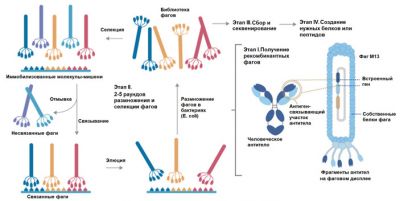
Существенным плюсом метода Уинтера является в первую очередь уход от необходимости использования иммунизированных животных для получения антител и гибридом (гибридов лимфоцитов и раковых клеток) для их массовой наработки. Фаговый дисплей — более быстрая, дешевая и гуманная методика. Кроме того, этот метод позволяет получать чисто человеческие антитела, что важно, если антитела используются в качестве лекарства — ведь антитела от животных, введенные в организм человека, сами по себе вызвали бы у человека сильный иммунный ответ.
Если требуется получить не только эффективное, но и специфичное связывание, то не составит труда включить в общую схему этап отбора против неселективно взаимодействующих частиц. В настоящее время фаговый дисплей используется отнюдь не только в небольших лабораториях, но и в массовом производстве лекарств и реактивов на основе антител (а информация о пептидах, связывающих разные антигены, собирается в общедоступную базу данных BDB). Вот лишь некоторые сферы их применения: обнаружение антигенов в исследуемых образцах (в частности, в целях диагностики), приготовление вакцин, противоопухолевые антитела, антитела для подавления аутоиммунных реакций, антитоксины, направленная доставка лекарств к больным тканям (включая раковые опухоли). В последнее десятилетие эту технологию научились применять и для более эффективной эволюции и отбора белков с ферментативной активностью.
В заключение следует сказать, что мы находимся отнюдь не в конце пути, а лишь в его начале (как обычно). Необходимость применения метода случайного поиска говорит нам о том, как мало мы еще знаем и насколько слабы наши предсказательные возможности. Но по мере того, как накапливаются знания, приобретенные методом проб и ошибок, мы все же двигаемся в сторону повышения разрешения картинки, по которой мы судим об окружающем мире.
Татьяна Романовскаяwww.elementy.ru
На развитие сайта